初中化学知识点&学习方法合集
点击领取>>>414份!北京初中上学期各科期末试卷&期末知识点整理
1.化学变化的基本特征?
有新物质生成
2.化学变化的关键词(至少5个)
燃烧、腐蚀、变质、酿酒、光合作用、呼吸作用、生锈
3.描述水的构成奥秘
①水是由水分子构成的
②每个水分子由两个氢原子和一个氧原子构成
③水由氢氧元素组成
4.保持水化学性质的微粒是?
水分子
5.科学探究过程中收集证据包括哪些环节?
设计实验方案、进行实验
6.固体药品存放在?粉末状用什么取用?块状固体用什么取用?
广口瓶/药匙或纸槽/镊子
7.酒精灯用什么点燃?如何熄灭?用哪部分加热?
火柴/灯帽盖灭/外焰
8.液体加热的注意事项
液体体积不超过1/3
试管夹夹持在离口1/3处
擦干外壁再加热,先预热再加热
倾斜45°
9.量筒的用途?集气瓶的用途?
①量度液体的体积
②收集或储存少量气体
10.三态变化中,水分子的情况?
水分子的数目和大小不变,间隔和排列方式改变
11.分子的基本性质
分子的质量和体积很小;相互间有间隔;总在不停地运动
12.水的天然循环通过什么实现的?
三态变化
13.沉降除去哪些杂质?通常加入?作用是?
大颗粒不溶性杂质/明矾/加速泥沙沉降
14.过滤除去哪些杂质?过滤用到的仪器?玻璃棒的作用?
小颗粒不溶性杂质/烧杯、漏斗、玻璃棒、铁架台(带铁圈)/引流
15.过滤后滤液浑浊的原因?
滤纸破损、液面高于滤纸、仪器本身不干净
16.过滤慢的原因?
杂质过多、滤纸未紧贴漏斗内壁
17.除去水中有颜色和异味的杂质通常加入?作用?
活性炭/吸附
18.如何去除可溶性杂质?
蒸馏
19.水中的微生物如何除?属于什么变化?
杀菌消毒/化学变化
20.硬水和软水如何区分?软水对应的现象?生活中如何降低水的硬度?
肥皂水/泡沫丰富/煮沸
21.举例说出两种混合物、两种纯净物
混合物—空气、海水、石头等;
纯净物—氢气、水、氧气等
22.电解水过程中,正极---气体?怎么验证的?现象?说明气体的性质?
氧气、带火星的木条、木条复燃、助燃性
负极---气体?怎么验证的?现象?说明气体的性质?
氢气、点燃的火柴、气体被点燃,火焰呈淡蓝色、可燃性
23.化学变化的实质?
破坏旧分子,形成新分子,即原子的重新组合
24.用微观角度解释化学变化中一定不变的是?一定改变的是?可能改变的是?
原子的种类和数目/分子的种类/分子的数目
25.化学变化中,最小的微粒?
原子
26.电解水文字表达式?氢气燃烧的文字表达式?
水 水氢气+氧气
水氢气+氧气
氢气+氧气→水
27.通过电解水实验得到的结论是什么?
①电解水生成氢气和氧气
②正氧负氢,氢二氧一
③水由氢氧元素组成
28.点燃氢气前应进行什么操作?
验纯
29.分解反应、化合反应的特点?
一变多、多变一,都是化学反应
30.原子的结构,并注明各微粒的带电情况

31.原子中的等量关系
质子数=核电荷数=核外电子数
32.决定原子种类的是?
质子数
33.哪些物质是由原子直接构成的?
金属、稀有气体、石墨金刚石
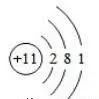
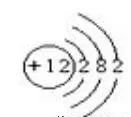
34.画出钠原子、镁原子的结构示意图
35.构成物质的微粒有哪些?各列举两例
分子---水和大部分气体
原子---金属、金刚石、稀有气体
离子---氯化钠、氧化镁
36.写出钠离子、镁离子、氯离子、硫离子的符号
Na+Mg2+Cl-S2-
37.原子的化学性质由什么决定?
最外层电子数
38.相对原子质量的定义表达式?

39.一种元素和另外一种元素的区别
质子数不同
40.元素符号的意义?Fe这一符号的意义
一种元素,代表这种元素的一个原子
铁元素、一个铁原子、铁
41.元素在地壳中的分布由大到小的顺序为?
氧硅铝铁钙
42.列举生活中常见的溶液?至少5种
糖水、茶水、啤酒、白醋、消毒酒精、碳酸饮料
43.溶液的特征
均一、稳定
44.溶液的组成
溶质、溶剂
45.溶于水温度升高的是?降低的是?
氢氧化钠、硝酸铵
46.汽油去油污的原理?
溶解
47.洗涤剂去油污的原理?
乳化
48.托盘天平称量药品时,不能把药品直接放在托盘里,应如何做?
没有腐蚀性的---纸片;有腐蚀性的---烧杯中
49.量筒用来量度液体的体积,读数时应注意?
视线与凹液面的最低处保持水平
50.在描述饱和溶液的时候,应注意强调哪三点?
一定的温度;一定量的溶剂;该物质
51.溶液是否饱和的判断方法?
首先看溶液中是否有未溶解的固体,
如果有,则此时的溶液已经达到饱和状态
如果没有,再向溶液中加入少量该溶质看是否继续溶解
52.饱和溶液如何转变为不饱和溶液?
加入溶剂,改变温度
53.溶质质量分数的表达式?
溶质质量分数=(溶质质量/溶液质量)×100%
54.配制一定溶质质量分数的溶液基本步骤包括?
计算---称量---溶解---装瓶存放
55.配制一定溶质质量分数的溶液用到哪些仪器?
托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒
56.玻璃棒在配制溶液中的作用?
搅拌,加速溶解
57.在配制一定溶质质量分数的溶液时,导致溶质质量分数偏小的原因可能有哪些?
药品不纯;量取水时仰视;烧杯或试剂瓶内壁有水;物质和砝码放反,且使用游码
58.空气中含量最多的气体是?体积分数是多少?
氮气;78%
59.空气中各成分由多到少排序?
氮气---氧气---稀有气体---二氧化碳---其它
60.测定空气中氧气含量时,可选用的药品有哪些?为什么不选择木炭?
铜粉、红磷;木炭与氧气加热会生成二氧化碳气体
61.铜粉加热的文字表达式/现象?
铜+氧气 →氧化铜,红色粉末变黑
62.氧气含量测定时,有哪些注意事项?
药品要充足、装置要密封、冷却至室温再读数
63.简述空气中各成分分离的简要过程?该过程属于什么变化?
通过降温加压使空气液化,然后加热液态空气,利用空气中各成分的沸点的不同,使其在不同的温度下气化,从而将各种气体分离出来。
64.分离空气能得到哪些气体?
氮气、稀有气体、氧气
65.氧气的主要用途?
①供给生物呼吸②支持燃料燃烧
66.氮气的主要用途?
①生产硝酸和氮肥②延长食品保质期③液氮制冷
67.稀有气体的主要用途?
①保护气②电光源
68.记入空气污染指数的有哪些物质?
CO NO2SO2O3可吸入颗粒物、总悬浮颗粒物
69.化学式H2O具有哪些含义?
宏观:①水
②水由氢氧两种元素组成
微观:①一个水分子
②一个水分子由两个氢原子和一个氧原子构成
70.化学式Fe具有哪些含义?
宏观:①铁②铁元素
微观:①一个铁原子
71.写出下列化学式中数字2的意义
2H2O:2指2个水分子 2指一个水分子中含有2个氢原子
Mg2+:每个镁离子带2个单位的正电荷
CaO :在氧化钙中,钙元素表现+2价
72.计算下列物质的化学式量:
H2O---18
CO2---44
Ca (OH)2---74
73.实验室制取氧气用到的药品是什么?
过氧化氢溶液、二氧化锰
74.实验室制取氧气使用分液漏斗的优点?
控制化学反应速率
75.实验室可以用什么方法收集氧气?为什么?
向上排空气法---氧气的密度比空气的大,且不与空气中的成分反应
排水法---氧气不易溶于水,且不与水发生反应
76.收集氧气时,用什么方法验满?
将带火星的木条放在集气瓶口,若复燃则满
77.组装好装置后,该同学先向分液漏斗中加入水,然后将导管另一端浸入水中,并打开分液漏斗的活塞,观察导管口是否有气泡冒出,该操作的目的是什么?
检验装置气密性
78.催化剂的特点是什么?
一变:化学反应速率改变(加快或是减慢)
二不变:质量不变、化学性质不变
79.实验室制取氧气的化学方程式
2KMnO4 K2MnO4+ MnO2+ O2↑
K2MnO4+ MnO2+ O2↑
2KClO32KCl + 3O2↑
H2O22H2O+ O2↑
80.二氧化锰的作用是什么?
催化作用
81.选择发生装置和收集装置的依据?
发生装置---反应物的状态和反应条件
收集装置---气体的密度和溶解性
82.实验室制取氧气用到的实验仪器是什么?(列举三例)
分液漏斗、锥形瓶、集气瓶、水槽等
83.描述铁丝在纯氧中燃烧的现象
剧烈燃烧、火星四射、放热、生成黑色固体
84.铁丝在纯氧中燃烧的化学方程式
3Fe + 2O2 Fe3O4
Fe3O4
85.氧化反应的判断
是否有氧气参加
86.氧化物的判断
二中有氧(两种元素、化合物、有氧元素)
87.收集满氧气的集气瓶为什么要正放在桌面?
氧气的密度比空气的大
88.铁丝燃烧实验,加水或细沙的目的
防止生成物炸裂集气瓶
89.实验室制取氧气的化学方程式
2H2O2 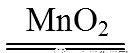 2H2O + O2↑
2H2O + O2↑
甲烷燃烧的方程式:
CH4+ 2O2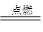 CO2+2H2O
CO2+2H2O
铁丝在纯氧中燃烧的方程式:
3Fe+ 2O2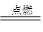 Fe3O4
Fe3O4
90.燃烧需要满足的条件是?灭火的原理三条?
物质具有可燃性,可燃物与氧气充分接触,温度达到着火点。
隔绝氧气,移走可燃物,降低温度。
91.促进燃烧的方法有哪些?
增大氧气浓度,增大可燃物与氧气的接触面积。
92.爆炸发生的条件?
可燃性气体或粉尘、爆炸极限、明火、有限的空间
93.三大化石燃料的共同点?
不可再生、混合物、都含有碳氢元素、燃烧生成二氧化碳和水
94.煤的综合利用包括哪些过程?属于什么变化?
煤的气化、焦化和液化。属于化学变化。
95.化石燃料的燃烧对环境的影响?
温室效应
大气污染:粉尘;产生SO2、氮的氧化物从而造成酸雨;燃烧不充分,一氧化碳污染
96.产生和消耗二氧化碳的主要途径?
产生:化石燃料的燃烧和生物的呼吸作用。消耗:植物的光合作用。
97.实验室制取二氧化碳所用药品:大理石或石灰石和稀盐酸
制取二氧化碳的化学方程式:
CaCO3+2HCl=CaCl2+H2O+CO2↑
收集方法:向上排空气法
验满方法:燃着的木条放在瓶口,熄灭则满
二氧化碳不能用排水法收集的原因:二氧化碳能溶于水
98.二氧化碳能用于灭火的原因是什么?还有什么其他用途(列两种)?
二氧化碳不能燃烧也不支持燃烧。气体肥料,人工降雨。
99.检验二氧化碳的方法?原理?
将气体通入澄清石灰水中,变浑浊则为二氧化碳。
CO2+ Ca(OH)2= CaCO3↓ + H2O
100.二氧化碳为什么能使紫色石蕊试液变红?
CO2+H2O=H2CO3
接下来是整理了一份初中全册常考知识点汇总,建议大家收藏背诵哦~
一、初中化学常见物质的分类
1、单质:非惰性气体一般由两个原子组成:F2,O2,H2,Cl2
2、惰性气体:一般由一个原子组成:He,Ne,Ar,Kr,Xe
3、化合物:氢化物居多:H2S,HCl,H3P,HF,HBr,HI
二、初中化学常见物质的颜色
(一)、固体的颜色
1、红色固体:铜,氧化铁
2、绿色固体:碱式碳酸铜
3、蓝色固体:氢氧化铜,硫酸铜晶体
4、紫黑色固体:高锰酸钾
5、淡黄色固体:硫磺
6、无色固体:冰,干冰,金刚石
7、银白色固体:银,铁,镁,铝,汞等金属
8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)
9、红褐色固体:氢氧化铁
10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁
(二)、液体的颜色
11、无色液体:水,双氧水
12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液
13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液
15、紫红色溶液:高锰酸钾溶液
16、紫色溶液:石蕊溶液
(三)、气体的颜色
17、红棕色气体:二氧化氮
18、黄绿色气体:氯气
19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢等气体。
三、初中化学敞口置于空气中质量改变的
(一)、质量增加的
1、由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸;
2、由于跟水反应而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜;
3、由于跟二氧化碳反应而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙;
(二)、质量减少的
1、由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水;
2、由于风化而减少的:碳酸钠晶体。
四、初中化学物质的检验
(一)、气体的检验
1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.
2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.
3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.
4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.
5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.
(二)、离子的检验.
6、氢离子:滴加紫色石蕊试液/加入锌粒
7、氢氧根离子:酚酞试液/硫酸铜溶液
8、碳酸根离子:稀盐酸和澄清的石灰水
9、氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子
10、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡
11、铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口
12、铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子
13、铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子
(三)、相关例题
14、如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质
15、检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石
16、检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCl。
五、初中化学之三
1、我国古代三大化学工艺:造纸,制火药,烧瓷器。
2、氧化反应的三种类型:爆炸,燃烧,缓慢氧化。
3、构成物质的三种微粒:分子,原子,离子。
4、不带电的三种微粒:分子,原子,中子。
5、物质组成与构成的三种说法:
(1)、二氧化碳是由碳元素和氧元素组成的;
(2)、二氧化碳是由二氧化碳分子构成的;
(3)、一个二氧化碳分子是由一个碳原子和一个氧原子构成的。
6、构成原子的三种微粒:质子,中子,电子。
7、造成水污染的三种原因:(1)工业“三废”任意排放,(2)生活污水任意排放
(3)农药化肥任意施放
8、收集方法的三种方法:排水法(不容于水的气体),
向上排空气法(密度比空气大的气体),
向下排空气法(密度比空气小的气体)。
9、质量守恒定律的三个不改变:原子种类不变,原子数目不变,原子质量不变。
10、不饱和溶液变成饱和溶液的三种方法:增加溶质,减少溶剂,改变温度(升高或降低)。
11、复分解反应能否发生的三个条件:生成水、气体或者沉淀
12、三大化学肥料:N、P、K
13、排放到空气中的三种气体污染物:一氧化碳、氮的氧化物,硫的氧化物。
14、燃烧发白光的物质:镁条,木炭,蜡烛(二氧化碳和水)。
15、具有可燃性,还原性的物质:氢气,一氧化碳,单质碳。
16、具有可燃性的三种气体是:氢气(理想),一氧化碳(有毒),甲烷(常用)。
17、CO的三种化学性质:可燃性,还原性,毒性。
18、三大矿物燃料:煤,石油,天然气。(全为混合物)
19、三种黑色金属:铁,锰,铬。
20、铁的三种氧化物:氧化亚铁,三氧化二铁,四氧化三铁。
21、炼铁的三种氧化物:铁矿石,焦炭,石灰石。
22、常见的三种强酸:盐酸,硫酸,硝酸。
23、浓硫酸的三个特性:吸水性,脱水性,强氧化性。
24、氢氧化钠的三个俗称:火碱,烧碱,苛性钠。
25、碱式碳酸铜受热分解生成的三种氧化物:氧化铜,水(氧化氢),二氧化碳。
26、实验室制取CO2不能用的三种物质:硝酸,浓硫酸,碳酸钠。
27、酒精灯的三个火焰:内焰,外焰,焰心。
28、使用酒精灯有三禁:禁止向燃着的灯里添加酒精,禁止用酒精灯去引燃另一只酒精灯,禁止用嘴吹灭酒精灯。
29、玻璃棒在粗盐提纯中的三个作用:搅拌、引流、转移
30、液体过滤操作中的三靠:(1)倾倒滤液时烧杯口紧靠玻璃棒,(2)玻璃棒轻靠在三层滤纸的一端,(3)漏斗下端管口紧靠烧杯内壁。
31、固体配溶液的三个步骤:计算,称量,溶解。
32、浓配稀的三个步骤:计算,量取,溶解。
33、浓配稀的三个仪器:烧杯,量筒,玻璃棒。
34、三种遇水放热的物质:浓硫酸,氢氧化钠,生石灰。
35、过滤两次滤液仍浑浊的原因:滤纸破损,仪器不干净,液面高于滤纸边缘。
36、药品取用的三不原则:不能用手接触药品,不要把鼻孔凑到容器口闻药品的气味,不得尝任何药品的味道。
37、金属活动顺序的三含义:
(1)金属的位置越靠前,它在水溶液中越容易失去电子变成离子,它的活动性就越强;
(2)排在氢前面的金属能置换出酸里的氢,排在氢后面的金属不能置换出酸里的氢;
(3)排在前面的金属能把排在后面的金属从它们的盐溶液中置换出来。
38、温度对固体溶解度的影响:
(1)大多数固体物质的溶解度随着温度的升高而增大,
(2)少数固体物质的溶解度受温度影响变化不大
(3)极少数固体物质的溶解度随着温度的升高而减小。
39、影响溶解速度的因素:(1)温度,(2)是否搅拌(3)固体颗粒的大小
40、使铁生锈的三种物质:铁,水,氧气。
41、溶质的三种状态:固态,液态,气态。
42、影响溶解度的三个因素:溶质的性质,溶剂的性质,温度。
六、初中化学常见混合物的重要成分
1、空气:氮气(N2)和氧气(O2)
2、水煤气:一氧化碳(CO)和氢气(H2)
3、煤气:一氧化碳(CO)
4、天然气:甲烷(CH4)
5、石灰石/大理石:(CaCO3)
6、生铁/钢:(Fe)
7、木炭/焦炭/炭黑/活性炭:(C)
8、铁锈:(Fe2O3)
七、初中化学常见物质俗称
1、氯化钠(NaCl):食盐
2、碳酸钠(Na2CO3):纯碱,苏打,口碱
3、氢氧化钠(NaOH):火碱,烧碱,苛性钠
4、氧化钙(CaO):生石灰
5、氢氧化钙(Ca(OH)2):熟石灰,消石灰
6、二氧化碳固体(CO2):干冰
7、氢氯酸(HCl):盐酸
8、碱式碳酸铜(Cu2(OH)2CO3):铜绿
9、硫酸铜晶体(CuSO4.5H2O):蓝矾,胆矾
10、甲烷(CH4):沼气
11、乙醇(C2H5OH):酒精
12、乙酸(CH3COOH):醋酸
13、过氧化氢(H2O2):双氧水
14、汞(Hg):水银
15、碳酸氢钠(NaHCO3):小苏打
八、物质的除杂
1、CO2(CO):把气体通过灼热的氧化铜,
2、CO(CO2):通过足量的氢氧化钠溶液
3、H2(水蒸气):通过浓硫酸/通过氢氧化钠固体
4、CuO(C):在空气中(在氧气流中)灼烧混合物
5、Cu(Fe):加入足量的稀硫酸
6、Cu(CuO):加入足量的稀硫酸
7、FeSO4(CuSO4):加入足量的铁粉
8、NaCl(Na2CO3):加入足量的盐酸
9、NaCl(Na2SO4):加入足量的氯化钡溶液
10、NaCl(NaOH):加入足量的盐酸
11、NaOH(Na2CO3):加入足量的氢氧化钙溶液
12、NaCl(CuSO4):加入足量的氢氧化钡溶液
13、NaNO3(NaCl):加入足量的硝酸银溶液
14、NaCl(KNO3):蒸发溶剂
15、KNO3(NaCl):冷却热饱和溶液。
16、CO2(水蒸气):通过浓硫酸。
九、化学之最
1、未来最理想的燃料是H2。
2、最简单的有机物是CH4。
3、密度最小的气体是H2。
4、相对分子质量最小的物质是H2。
5、相对分子质量最小的氧化物是H2O。
6、化学变化中最小的粒子是原子。
7、PH=0时,酸性最强,碱性最弱。
PH=14时,碱性最强,酸性最弱。
8、土壤里最缺乏的是N,K,P三种元素,肥效最高的氮肥是尿素。
9、天然存在最硬的物质是金刚石。
10、最早利用天然气的国家是中国。
11、地壳中含量最多的元素是氧。
12、地壳中含量最多的金属元素是铝。
13、空气里含量最多的气体是氮气。
14、空气里含量最多的元素是氮。
15、当今世界上最重要的三大化石燃料是煤,石油,天然气。
16、形成化合物种类最多的元素:碳
十、有关不同
1、金刚石和石墨的物理性质不同:是因为碳原子排列不同。
2、生铁和钢的性能不同:是因为含碳量不同。
3、一氧化碳和二氧化碳的化学性质不同:是因为分子构成不同。
(氧气和臭氧的化学性质不同是因为分子构成不同;水和双氧水的化学性质不同是因为分子构成不同。)
4、元素种类不同:是因为质子数不同。
5、元素化合价不同:是因为最外层电子数不同。
6、钠原子和钠离子的化学性质不同:是因为最外层电子数不同
十一、有毒的物质
1、有毒的固体:亚硝酸钠(NaNO2),乙酸铅等;
2、有毒的液体:汞,硫酸铜溶液,甲醇,含Ba2+的溶液(除BaSO4);
3、有毒的气体:CO,氮的氧化物,硫的氧化物。
十二、实验室制法
1、实验室氧气:2KMnO4=====2K2MnO4+MnO2+O2↑
2KClO3=======2KCl+3O2↑
2H2O2=======2H2O+O2↑
2、实验室制氢气
Zn+H2SO4===ZnSO4+H2↑(常用);Fe+H2SO4===FeSO4+H2↑
Mg+H2SO4===MgSO4+H2↑;2Al+3H2SO4==Al2(SO4)3+3H2↑
Zn+2HCl===ZnCl2+H2↑;Fe+2HCl===FeCl2+H2↑
Mg+2HCl===MgCl2+H2↑;2Al+6HCl===2AlCl3+3H2↑
4、实验室制CO2:
CaCO3+2HCl==CaCl2+CO2↑+H2O
十三、工业制法
1、O2:分离液态空气
2、CO2:高温煅烧石灰石(CaCO3=========CaO+CO2↑)
3、H2:天然气和水煤气
4、生石灰:高温煅烧石灰石(CaCO3=========CaO+CO2↑)
5、熟石灰:CaO+H2O==Ca(OH)2
6、烧碱:Ca(OH)2+Na2CO3===CaCO3↓+2Na OH
十四、初中常见化学反应归类
(一)、化合反应
1、镁在空气中燃烧:2Mg+O2点燃2MgO
2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O4
3、铝在空气中燃烧:4Al+3O2点燃2Al2O3
4、氢气在空气中燃烧:2H2+O2点燃2H2O
5、红磷在空气中燃烧:4P+5O2点燃2P2O5
6、硫粉在空气中燃烧:S+O2点燃SO2
7、碳在氧气中充分燃烧:C+O2点燃CO2
8、碳在氧气中不充分燃烧:2C+O2点燃2CO
9、二氧化碳通过灼热碳层:C+CO2高温2CO
10、一氧化碳在氧气中燃烧:2CO+O2点燃2CO2
11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO3
12、生石灰溶于水:CaO+H2O=Ca(OH)2
13、无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4?5H2O
14、钠在氯气中燃烧:2Na+Cl2点燃2NaCl
(二)、分解反应
15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+O2↑
16、加热高锰酸钾:2KMnO4加热K2MnO4+MnO2+O2↑
17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑
18、碳酸不稳定而分解:H2CO3=H2O+CO2↑
19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+CO2↑
(三)、置换反应
20、铁和硫酸铜溶液反应:Fe+CuSO4=FeSO4+Cu
21、锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑
22、镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑
23、氢气还原氧化铜:H2+CuO加热Cu+H2O
24、木炭还原氧化铜:C+2CuO高温2Cu+CO2↑
25、甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O
26、水蒸气通过灼热碳层:H2O+C高温H2+CO
27、焦炭还原氧化铁:3C+2Fe2O3高温4Fe+3CO2↑
(四)、其他
28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4
29、甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O
30、酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O
31、一氧化碳还原氧化铜:CO+CuO加热Cu+CO2
32、一氧化碳还原氧化铁:3CO+Fe2O3高温2Fe+3CO2
33、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO2=CaCO3↓+H2O
34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+CO2====Na2CO3+H2O
35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):
CaCO3+2HCl===CaCl2+H2O+CO2↑
36、碳酸钠与浓盐酸反应(泡沫灭火器的原理):Na2CO3+2HCl===2NaCl+H2O+CO2↑
十五、初中化学常考的几个反应
(一)、物质与氧气的反应
(1)单质与氧气的反应:
1.镁在空气中燃烧:2Mg+O2点燃2MgO
2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O4
3.铜在空气中受热:2Cu+O2加热2CuO
4.铝在空气中燃烧:4Al+3O2点燃2Al2O3
5.氢气中空气中燃烧:2H2+O2点燃2H2O
6.红磷在空气中燃烧:4P+5O2点燃2P2O5
7.硫粉在空气中燃烧:S+O2点燃SO2
8.碳在氧气中充分燃烧:C+O2点燃CO2
9.碳在氧气中不充分燃烧:2C+O2点燃2CO
(2)化合物与氧气的反应:
10.一氧化碳在氧气中燃烧:2CO+O2点燃2CO2
11.甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O
2022初中化学知识点之28种化学基本概念。
1.化学变化:生成了其他物质的变化
2.物理变化:没有生成其他物质的变化
3.物理性质:不需要发生化学变化就表现出来的性质
(如:颜色、状态、密度、气味、熔点、沸点、硬度、水溶性等)
4.化学性质:物质在化学变化中表现出来的性质
(如:可燃性、助燃性、氧化性、还原性、酸碱性、稳定性等)
5.纯净物:由一种物质组成
6.混合物:由两种或两种以上纯净物组成,各物质都保持原来的性质
7.元素:具有相同核电荷数(即质子数)的一类原子的总称
8.原子:是在化学变化中的最小粒子,在化学变化中不可再分
9.分子:是保持物质化学性质的最小粒子,在化学变化中可以再分
10.单质:由同种元素组成的纯净物
11.化合物:由不同种元素组成的纯净物
12.氧化物:由两种元素组成的化合物中,其中有一种元素是氧元素
13.化学式:用元素符号来表示物质组成的式子
14.相对原子质量:以一种碳原子的质量的 1/12 作为标准,其他原子的质量跟它比较所得的值
某原子的相对原子质量= 某原子的质量÷(一种碳原子的质量的 1/12)
相对原子质量 ≈ 质子数 + 中子数 (因为原子的质量主要集中在原子核)
15.相对分子质量:化学式中各原子的相对原子质量的总和
16.离子:带有电荷的原子或原子团
17.原子的结构:
原子、离子的关系:
注:在离子里,核电荷数 = 质子数 ≠ 核外电子数
18.四种化学反应基本类型:(见文末具体总结)
①化合反应:由两种或两种以上物质生成一种物质的反应。
如:A + B = AB
②分解反应:由一种物质生成两种或两种以上其他物质的反应。
如:AB = A + B
③置换反应:由一种单质和一种化合物起反应,生成另一种单质和另一种化合物的反应。
如:A + BC = AC + B
④复分解反应:由两种化合物相互交换成分,生成另外两种化合物的反应。
如:AB + CD = AD + CB
19.还原反应:在反应中,含氧化合物的氧被夺去的反应(不属于化学的基本反应类型)。
氧化反应:物质跟氧发生的化学反应(不属于化学的基本反应类型) 。
缓慢氧化:进行得很慢的,甚至不容易察觉的氧化反应。
自燃:由缓慢氧化而引起的自发燃烧。
20.催化剂:在化学变化里能改变其他物质的化学反应速率,而本身的质量和化学性在化学变化前后都没
有变化的物质(注:2H2O2 === 2H2O + O2 ↑ 此反应 MnO2是催化剂)
21.质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成物质的质量总和。
(反应的前后,原子的数目、种类、质量都不变;元素的种类也不变)
22.溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物
溶液的组成:溶剂和溶质。(溶质可以是固体、液体或气体;固、气溶于液体时,固、气是溶质,液
体是溶剂;两种液体互相溶解时,量多的一种是溶剂,量少的是溶质;当溶液中有水存在时,不论水的量
有多少,我们习惯上都把水当成溶剂,其他为溶质。)
23.固体溶解度:在一定温度下,某固态物质在 100 克溶剂里达到饱和状态时所溶解的质量,就叫做这
种物质在这种溶剂里的溶解度
24.酸:电离时生成的阳离子全部都是氢离子的化合物
如:HCl==H+ + Cl-
HNO3==H+ + NO3 -
H2SO4==2H+ + SO4 2-
碱:电离时生成的阴离子全部都是氢氧根离子的化合物
如:KOH==K+ + OH-
NaOH==Na+ + OH-
Ba(OH)2==Ba2+ + 2OH-
盐:电离时生成金属离子和酸根离子的化合物
如:KNO3==K+ + NO3 -
Na2SO4==2Na+ + SO4 2-
BaCl2==Ba2+ + 2Cl-
25.酸性氧化物(不一定属于非金属氧化物):凡能跟碱起反应,生成盐和水的氧化物。
碱性氧化物(属于金属氧化物):凡能跟酸起反应,生成盐和水的氧化物。
26.结晶水合物:含有结晶水的物质(如:Na2CO3·10H2O、CuSO4·5H2O)FeSO4·7H2O
27.潮解:某物质能吸收空气里的水分而变潮的现象。
风化:结晶水合物在常温下放在干燥的空气里,能逐渐失去结晶水而成为粉末的现象。
28.燃烧:可燃物跟氧气发生的一种发光发热的剧烈的氧化反应。
燃烧的条件:①可燃物;②氧气(或空气);③可燃物的温度要达到着火点。
化学知识点之基本知识与理论学习,收集相关资讯供大家参考学习。




微信公众号搜索: 北京小学学习资料 家长升学指南 关注公众号,获取最新资讯!

扫码添加“家长论坛”微信好友(微信号 16619908263)
咨询北京初中、中考相关政策请拨打电话 16619908263 (同微信号)
没有找到相关结果
0 个回复